2025年成考高起点《理化综合》每日一练试题08月20日
2025-08-20 12:02:16 来源:勒克斯教育网
2025年成考高起点《理化综合》每日一练试题08月20日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、下列气体中,能与人体中血红蛋白结合而引起中毒的是()
- A:
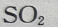
- B:

- C:CO
- D:
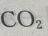
答 案:C
解 析:CO吸进肺里,会与血液中的血红蛋白结合成稳定的碳氧血红蛋白,随血液流遍全身。而且CO与血红蛋白的结合力,要比氧气与血红蛋白的结合力大200~300倍,碳氧血红蛋白的解离又比氧合血红蛋白缓慢约3600倍。因此,CO一经吸入,即与氧气争夺血红蛋白,同时由于碳氧血红蛋白的存在会妨碍氧合血红蛋白的正常解离,使血液的携氧功能发生障碍而造成机体缺氧。
2、可用分液漏斗分离的一组混合物是()。
- A:乙醇和水
- B:乙醛和水
- C:乙酸乙酯和水
- D:苯和苯酚
答 案:C
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、实验室选用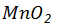 与10mol/L浓盐酸反应制备氯气,其化学反应方程式是 ,
与10mol/L浓盐酸反应制备氯气,其化学反应方程式是 ,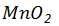 在反应中作 (填“氧化剂”或“还原剂”);若生成标准状况下氯气2.8L,反应中转移电子多少摩尔?消耗该盐酸溶液多少毫升?
在反应中作 (填“氧化剂”或“还原剂”);若生成标准状况下氯气2.8L,反应中转移电子多少摩尔?消耗该盐酸溶液多少毫升?
答 案:
解 析:
2、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: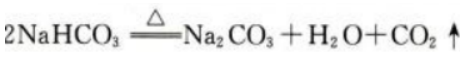 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
填空题
1、如图所示,为氢原子能级图的一部分。若氢原子在图示的能级中由于电子跃迁而放出能量为1.9eV(电子伏特)的光子,则可知电子从能级n=()跃迁到能级n=()。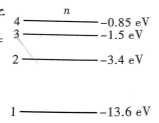
答 案:3;2
解 析:由计算可得−1.5eV−(−3.4eV)=1.9eV,即n=3能级跃迁到n=2能级。
2、A,B两元素的离子具有相同的电子数,A、B两元素的单质都能与水剧烈反应,在反应中A单质作还原剂,B单质作氧化剂,A与B反应的生成物是(),生成物的电子式为()
答 案:NaF;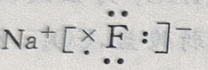
解 析:根据题给条件知:在反应中 A 单质作还原剂则为金属元素。B单质作氧化剂则为非金属。而非金属单质常温下能与水剧烈反应的只有 其阴离子为为2、8 结构,故A为Na。
其阴离子为为2、8 结构,故A为Na。
简答题
1、现有部分变质的亚硫酸钠试样,经测定含有5.3%的碳酸钠。称取40g试样,加入4 mol·L-1的盐酸600 mL,使其充分反应,放出的气体在标准状况下体积为4.928 L。求试样中亚硫酸钠的质量分数。
答 案:
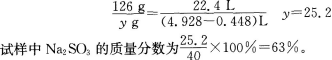
2、如图11-27所示,两根相距0.5m光滑平行金属导轨CE和C’E’放置在水平面上,两端分别连接电阻R1=R2=1Ω,AB的质量m=1kg,匀强磁场的磁感应强度B=0.2T,AB和导轨的电阻忽略不计,今给AB一个初动量,使其以初速度ν0=10m/s在导轨上向右运动,求:(1)AB开始运动时所受的磁场力.
(2)在AB运动过程中,R:上放出的热量.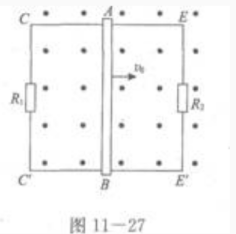
答 案:(1)当AB运动时切割磁感线,产生感应电动势。因此,它相当于一个电源。由图可见,外电路是 R1和R2的并联电路,由右手定则知,金属棒AB中的感应电流由A流向B.再用左手定则知,金属棒AB所受的磁场力F方向向左,与运动方向相反,由此可知,金属棒做减速运动,最后静止不动.当AB以速度v运动时,感应电动势为 因为R1与R2并联,所以电功率与电阻成反比,因此热量与电阻成反比,故有
因为R1与R2并联,所以电功率与电阻成反比,因此热量与电阻成反比,故有




