2025年成考高起点《理化综合》每日一练试题08月01日
2025-08-01 12:03:12 来源:勒克斯教育网
2025年成考高起点《理化综合》每日一练试题08月01日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、R元素的最高价氧化物的分子式是R2O5,R的气态化物在标准状况下466ml的质量是0.354g,则R元素的相对原子质量是()
- A:31
- B:75
- C:122
- D:14
答 案:D
2、下列说法正确的是()。
- A:官能团相同的物质一定具有相同的性质
- B:通式相同的物质一定具有相同的性质
- C:某有机物完全燃烧生成CO2和H2O,则该有机物中一定含有C、H、O三种元素
- D:分子式为CH4O的有机物只代表一种物质
答 案:D
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、如图,水平面内有两条相距L的平行金属导轨,导轨足够长,其左端接有一阻值为R的电阻,导体棒ab放置在导轨上。空间存在垂直于导轨所在平面的匀强磁场,磁感应强度大小为B。现使ab以恒定速度v沿导轨向右运动,运动过程中ab始终与导轨垂直并接触良好。不计导轨和导体棒的电阻。求(1)导体棒ab所受安培力的大小;(2)电阻R上消耗的功率。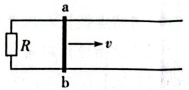
答 案:
解 析:
2、一绝缘细绳上端固定,下端连接在一质量m=0.08kg、长度l=0.4m的均匀金属棒中心,整个装置处在一匀强磁场中,磁场的磁感应强度大小B=0.5T,方向竖直向上,如图所示。现使一电流流过金属棒,已知电流大小I=3A,方向垂直于纸面向里,重力加速度大小g取10m/s2。求
(1)金属棒所受安培力的大小和方向。
(2)平衡后细绳中张力的大小及细绳与竖直方向夹角的正切值。
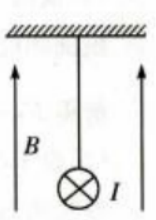
答 案:.(1)金属棒所受安培力为F=BIL=0.6N,根据左手定则知,方向水平向右。 (2)金属棒所受重力为G=mg=0.8N平衡后,安培力与重力的合力与绳中张力等大反向,设细绳与竖直方向的夹角为θ,则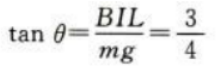 绳中张力大小为
绳中张力大小为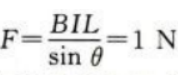
填空题
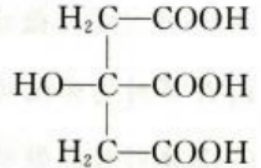
1、短周期元素X、Y、Z的原子序数依次增大。Z原子最外层电子数与最内层电子数相等;Y原子最外层电子数是内层电子数的3倍;X原子核外电子数比Y原子少1个,X原子的结构示意图(),化合物ZY的电子式为()。
答 案: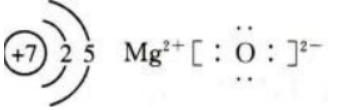
解 析:本题考查了短周期元素原子核外电子排布和电子式书写的知识点。 根据短周期元素核外电子排布的规律可知,X应为N元素,Y应为O元素,Z应为Mg元素。
N的原子结构示意图为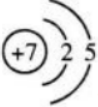 MgO为离子化合物,电子式为
MgO为离子化合物,电子式为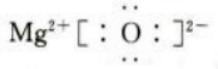
2、FeCl3溶液中先通入过量的SO2,再滴加BaCl2溶液,产生的白色沉淀为()(填化学式),说明SO,具有()性。
答 案:BaSO₄;还原
解 析:本题考查了二氧化硫的性质的知识点。 二氧化硫具有还原性,能与氧化铁发生氧化还原反应生成硫酸根,可用氯化钡检验生成的硫酸根。
简答题
1、往50mL稀硫酸和稀盐酸的混合溶液中加入2.1375g氢氧化钡粉末,充分反应后进行过滤,滤液的pH=13,其沉淀干燥后质量为1.165g试计算原混合溶液中的物质的量浓度
答 案:加入的Ba(OH)2的物质的量为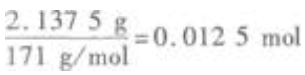 所得的沉淀是BaSO4,其物质的量为
所得的沉淀是BaSO4,其物质的量为  解得
解得
x=y=0.005 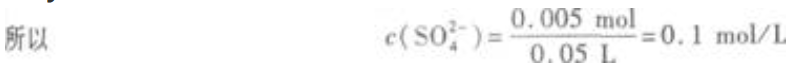 (2)溶液的pH=13,说明有Ba(OH)2剩余,且c(OH-)=0.1mol/L。 n(OH-)=0.1mol/L×0.05L=0.005mol
(2)溶液的pH=13,说明有Ba(OH)2剩余,且c(OH-)=0.1mol/L。 n(OH-)=0.1mol/L×0.05L=0.005mol
设剩余的Ba(OH)2为2mol,则 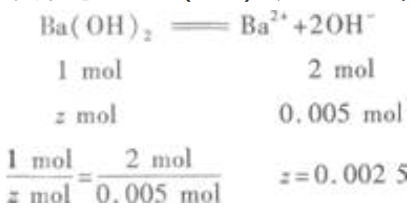 即剩余Ba(OH)20.0025mol。
即剩余Ba(OH)20.0025mol。
与HCl反应的Ba(OH)2的物质的量为0.0125mol-0.005mol-0.0O25mol=0.005mol
设溶液中HCl(Cl-)的物质的量为mmol,则 
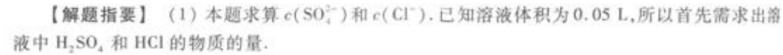 (2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4)。
(2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4)。
(3)因滤液的pH=13,可知Ba(OH)2与H2SO4、HCl反应后,仍有剩余。即加入的Ba(OH)2分为三部分:①与H2SO4反应,②与HCl反应,③剩余。根据BaSO4的物质的量可求出H2SO4消耗的Ba(OH)2,根据剩余溶液的pH=13可求得剩余的Ba(OH)2。所以用Ba(OH)2的总量,减去H2SO4消耗的量,再减去剩余的量,最后可得与HCl反应的Ba(OH)2的物质的量,并进一步由Ba(OH)2的物质的量求得HCl的物质的量。
2、往50 mL稀硫酸和稀盐酸的混合溶液中加入2.1375g氢氧化钡粉末,充分反应后进行过滤,测得滤液的pH=13,其沉淀干燥后质量为1.165g。试计算原混合溶液中 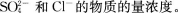
答 案: