2025年成考高起点《理化综合》每日一练试题08月04日
2025-08-04 12:14:11 来源:勒克斯教育网
2025年成考高起点《理化综合》每日一练试题08月04日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、实验室配制100mL 0.100 mol/L的NaCl溶液,下列仪器中无需选用的是
- A:容量瓶
- B:天平
- C:试管
- D:烧杯
答 案:C
解 析:一定物质的量浓度溶液的配制。首先用天平称量所需溶质放入烧杯中,用适量纯水溶解,把溶液转移到容量瓶里,纯水洗涤烧杯和玻璃棒,洗液倒入容量瓶中。再加入纯水至液面接近容量瓶刻度2∼3cm 处,改用胶头滴管加水,恰到刻度为止。塞紧瓶塞,反复摇匀即得所配溶液。故应选择C选项。
2、下列叙述中错误的是()。
- A:①③
- B:②③
- C:①④
- D:①③④
答 案:D
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、实验室选用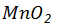 与10mol/L浓盐酸反应制备氯气,其化学反应方程式是 ,
与10mol/L浓盐酸反应制备氯气,其化学反应方程式是 ,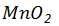 在反应中作 (填“氧化剂”或“还原剂”);若生成标准状况下氯气2.8L,反应中转移电子多少摩尔?消耗该盐酸溶液多少毫升?
在反应中作 (填“氧化剂”或“还原剂”);若生成标准状况下氯气2.8L,反应中转移电子多少摩尔?消耗该盐酸溶液多少毫升?
答 案:
解 析:
2、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: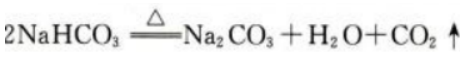 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
填空题
1、常温下,氨水中存在的离子有()
答 案: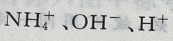
解 析:因为氨水在常温下存在以下电离平衡: 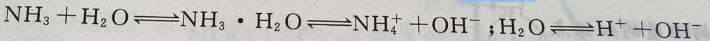
2、如图1-10所示,细线的上端固定于O点,下端系一个小球P,线长l=1.56m,已知小球在水平面内做以O'为圆心的匀速圆周运动,悬线与竖直方向的夹角θ=45°。求
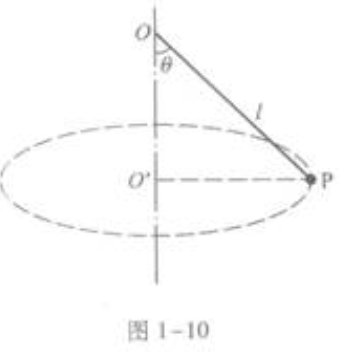
答 案:5.0rad/s
解 析:本题是匀速圆周运动的试题,它的考点有牛顿第二定律和向心力。 以小球为研究对象,小球受两个作用力,细线的拉力FT和重力G。FT沿细线向上,G竖直向下,图1-17是它的受力图。  小球在水平面内做匀速圆周运动,它所受的合外力是匀速圆周运动的向心力。因此,重力G和拉力FT的合力就是向心力F。 取平面直角坐标如图所示。
小球在水平面内做匀速圆周运动,它所受的合外力是匀速圆周运动的向心力。因此,重力G和拉力FT的合力就是向心力F。 取平面直角坐标如图所示。
FT的分量为
FTX=FTsinθ
FTY=FTcosθ
G的分量为
Gx=0
Gy=-mg
水平方向的牛顿方程为
FTx=FTsinθ=F=ma①
竖直方向的牛顿方程为
FTy+Gy=FTcosθ-mg=0
即FTy=FTcosθ=mg②
由式①、②解得
F=mgtanθ=mA.
把向心加速度  代入上式得
代入上式得
F=mRω2=mgtanθ
因此角速度为  圆周运动半径R与线长l的关系是
圆周运动半径R与线长l的关系是
R=lsinθ
代入上式解得  代入题给数值,算得
代入题给数值,算得 
简答题
1、用纯净的氯酸钾和二氧化锰混合物7.56g制取氧气,加热至不再有氧气放出为止,冷却后残留在容器里的固体物质为5.32g。问: (1)反应产生的氧气在标准状况下的体积为多少升?
(2)原混合物中有氢酸钾多少克?
答 案:按题意知,反应生成O2的质量为7.56g~5.32g=2.24g 2.24gO2占的体积为(标准状况)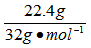 ×22.4L﹒mol-1=1.568L
×22.4L﹒mol-1=1.568L
设原合物中KClO3的质量为xg,根据反应的化学方程式 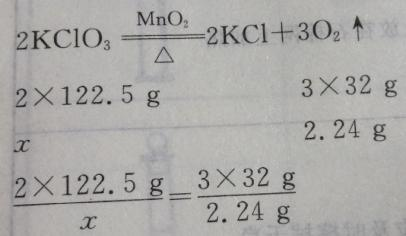 解得x=5.72g
解得x=5.72g
答:产生的O2在标准状况下的体积为1.568L,原混合物中含KClO35.72g。
2、如图1—15所示,两根轻质细杆AC、BC用铰链固定在墙上构成一个直角三角形支架,在C处挂一盏吊灯。已知AC=1.2m,BC=2m,吊灯重200N。求杆AC和BC所受力的大小和方向。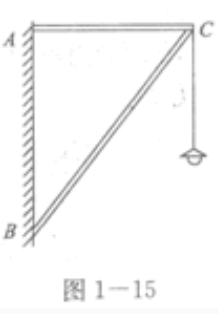
答 案:取C点为研究对象,分析其受力情况:绳子的拉力FT=G,AC杆的拉力FNl和BC杆的支持力 



